ベラルーシにおけるチェルノブイリ原発事故後の
小児甲状腺ガンの現状
菅谷 昭,ユーリ・E・デミチク,エフゲニー・P・デミチク
国立甲状腺ガンセンター(ベラルーシ)
はじめに
1996年4月,オーストリアのウィーンにおいてIAEA(国際原子力機関),WHO(世界保健機関),EU(欧州連合)の3者による合同国際会議,「チェルノブイリ事故から10年」が開催され,その時の総括として,現時点でこの事故と因果関係が明らかであると特定される健康障害は,小児の甲状腺ガンのみであると報告された1.一方,白血病やその他の疾病については,今後の経過をみないかぎり科学的に明確な結論をだすことはまだ時期尚早と述べている.
1990年以降,ベラルーシ,ウクライナ,ロシアのCIS3カ国における小児甲状腺ガンの著しい増加は共通の現象として確認されている.ちなみに,1995年末までに,この3ヶ国で約800名の小児が甲状腺ガンの治療を受け,そのうちの半数以上はベラルーシ共和国で発見され,外科治療が実施されている.さらにこの総括報告書には,1986年の事故当時15歳未満の小児から,科学的根拠の裏付けは乏しいものの,今後数1000人の甲状腺ガンの発生が予測されると記載されている.もしこれが事実であるとするならば,長期的かつ用意周到な対策を早急に立案し,その準備を講じておかないと,高度の汚染を被った国々では,近い将来,人類史上に類を見ない大きな禍根を残すことになりかねないであろう.
本稿では,ベラルーシ共和国における小児甲状腺ガンの実態に関する概略について述べる.チェルノブイリ事故後,甲状腺ガンが急激に増加をはじめると,ベラルーシ政府は,甲状腺ガン専門の診療・研究機関として,1990年保健省の管轄下に国立甲状腺ガンセンターを設立し,その責任者に,長年にわたりベラルーシにおける甲状腺疾患治療の第一人者として活躍してきた,ミンスク医科大学腫瘍学講座のデミチク教授を任命した.そして,ベラルーシ国内における小児甲状腺ガンの外科治療は,原則としてすべてセンターで実施されることが取り決められた.本稿の資料は,ベラルーシ国立甲状腺ガンセンターで手術を施行し,病理組織学的に甲状腺ガンと最終診断された症例に基づいて作成されたものである.
小児甲状腺ガンの現状
ベラルーシ全土における小児甲状腺ガンの患者数は表1に示す通りである.すなわち,事故前11年間(1975〜1985)ではわずか7名であった.しかし,事故後の11年間(1986〜1996)では508名と著明に増加し,それは事故前に比べ72倍にも達している.一方,成人についてみると,前者では1342名,後者では4006名と約3倍に増加している.しかしこの場合には,診断技術の向上や検診機会の増加といった「見せかけ」の要因を考えると,必ずしも事故による被曝にともなう増加とは言えず,今後のさらに詳しい追跡調査を継続する必要がある.
表1 ベラルーシにおけるチェルノブイリ事故前と事故後の甲状腺ガン数
|
年 |
大人 (15歳以上) |
子供 (15歳未満) |
|
1975-1985 |
1342 |
7 |
|
1986-1996 |
4006 |
508 |
甲状腺ガンセンターに紹介されてきた小児甲状腺ガン患者508名の出身地(州)を分類すると,ウクライナと接する高汚染州であるゴメリ州(268名:52.8%)およびブレスト州(122名:24.0%)からの小児が圧倒的多数を占めるという明らかな地理的特異性を示している(図1).
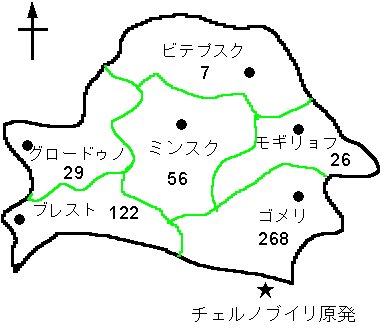
図1 ベラルーシにおける小児甲状腺ガンの地域分布(1986〜1996年:508件)
また,小児甲状腺ガン患者508名の誕生日を,チェルノブイリ事故を中心に3群に分類すると,事故前誕生例は497名(97.8%),事故当時誕生例は6名(1.2%),事故後誕生例は5名(1.0%)と,ほぼすべての小児が事故前に生まれていることが明らかとなった.さらに,1995年までの患者420名を基に,子供たち(手術時に15歳未満)の事故当時の年齢分布をみると,0〜4歳が66.2%,5〜9歳が31.4%,10〜14歳が2.4%と,半数以上の患者が乳幼児期に区分される極めて若年齢の小児であった(表2,図2).ただし,事故後に生まれた4名は除外してある.
表2 小児甲状腺ガン患者の事故当時の年齢分布
(1986〜1995)
|
地域 |
人口 (万人) |
小児甲状腺 ガン数 |
年齢別甲状腺ガン数 |
||
|
0 - 4 |
5 - 9 |
10 - 14 |
|||
|
ブレスト州 |
152 |
97 |
68 |
27 |
2 |
|
ビテプスク州 |
130 |
7 |
4 |
3 |
0 |
|
ゴメリ州 |
167 |
225 |
149 |
72 |
4 |
|
グロードゥノ州 |
116 |
24 |
12 |
11 |
1 |
|
ミンスク州 |
141 |
20 |
14 |
5 |
1 |
|
モギリョフ州 |
127 |
21 |
14 |
6 |
1 |
|
ミンスク市 |
163 |
26 |
17 |
8 |
1 |
|
ベラルーシ全体 |
996 |
420 |
278 |
132 |
10 |
|
% |
100 |
66.2 |
31.4 |
2.4 |
|
| 注:人口は1986年の値で大人も含まれる. | |||||
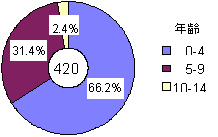
図2 小児甲状腺ガン患者の事故時の年齢分布
次に,ベラルーシ共和国における小児甲状腺ガンの発生頻度についてみると,事故前は小児10万人あたり年間0.1件と,世界のそれとほぼ類似の値を示していた.しかし,90年1.2件,92年2.8件,94年3.5件,95年4.0件,96年3.8件と明らかに上昇していることが判明した.そこで,これらの年度別発生頻度を,高汚染州であるゴメリ州に限定してみると,90年3.6件,91年11.3件,95年13.4件,96年12.0件と,91年以降は世界的平均の100倍以上にも達している.またブレスト州でも,96年は7.3件であった.これは極めて異常な事態と言わざるを得ない.一方,非常に軽度の汚染州であるビテプスク州では93年以降0件のままである.
ここに示した幾つかの臨床科学的データは,ベラルーシ共和国で急増する小児甲状腺ガンが,チェルノブイリ原発事故による放射能汚染によって誘発された可能性を強く示唆している2.なかでも,事故によって大量に放出された,ヨウ素131(半減期8日)などの放射性ヨウ素による甲状腺の被曝が最大の要因であろう.甲状腺では,ヨウ素を原料として甲状腺ホルモンの合成が行われるため,体内に摂取された放射性ヨウ素のほとんどすべては甲状腺に集まる.甲状腺に取り込まれた放射性ヨウ素による,局所的で集中的な事故当時の内部被曝の結果が,現在甲状腺ガンとなって現われていると考えるのが最も論理的である3,4.事故後に生まれ,ヨウ素被曝を受けていない子供たちに甲状腺ガンがほとんど認められていないことも,強力にこのことを裏付けている.しかし,発ガンのメカニズムに関する直接的な証明は現時点では極めて困難であり,またガン発生と被曝量との関連性についても今なお明確な結論が得られておらず,今後も詳細な基礎的検討が継続されるべきであろう.
ここで,最近の甲状腺ガン症例数の推移をみると,1995年に当ガンセンターで外科治療を受けた小児(15歳未満)は91例であり,96年は84例,97年は5月末までに27例と,漸次その数が減少する傾向にある.一方,93年頃より,15歳を超えた青年層の甲状腺ガン患者が増加してきている.具体的な数字を示すと,90年4例,91,92年はいずれも1例,しかし,93年になると25例,94年21例,95年25例,96年は10月末までに26例に手術が施行されている.つまり,事故当時に子供であった人々の年齢増加とともに,甲状腺ガン患者の年齢も上昇する傾向が認められている.また,これら10代後半の患者においても,小児の場合と同様に,明らかな地理的特徴,すなわち,高汚染州であるゴメリ州とブレスト州出身の患者が全体の70%を占めていることが明らかとなった.
今後は,これまで小児甲状腺ガンとして現われてきた事故影響が,10代後半,さらには大人の甲状腺ガンへと移行するであろうと推測される.
今後の問題点
若年齢の小児期に既に外科治療を受けた患者たちが,現在,思春期や青年期を迎えており,彼ら,ことに女の子たちは,間近に迫った結婚や妊娠,出産,そして生まれてくる子どもへの遺伝的影響などに大きな不安を募らせている.なかには,結婚や出産を回避しようとしている若年女子も見られている.
このようにチェルノブイリ事故による健康障害への影響は,今まさに始まったばかりである.今後,成長期にある小児のみならず彼らの親たちに対する臨床および社会心理学的ケアーの重要性がクローズアップされてくるものと考えられる.医療支援の取り組みの一環として,この方面からの教育的アプローチも考慮される必要があろう.
文献
- ONE DECADE AFTER CHERNOBYL: Summing Up the Consequences of the Accident, Proceedings of an International Conference, Vienna, 8-12 April 1996, IAEA STI/PUB/1001.
- Kazakov V.S., Demidchik E.P., Astakhova L.N. et.al., Thyroid Cancer after Chernobyl, Nature 359, 21-22, 1992.
- Socalow E.L., Hashizume A., Nerishi S. et al., Thyroid Carcinoma in Man after Exposure to Ionizing Radiation, N.Engl.J.Med., 268, 406-410, 1963.
- Maron H., Thomas S., Saenger E., et al., Ionizing Radiation and the Induction of Clinically Significant Disease in the Human Thyroid Gland, Am.J.Med., 63, 967-978, 1997