我々の研究室は平成29年度より京都大学(原子炉実験所)に設置された寄附講座 (寄附者:株式会社アサヒビジョン) に属しています。
研究目的: D-アミノ酸を分子指標とする加齢性疾患の研究と疾患の早期検出装置の開発
白内障、加齢黄斑変性症、アルツハイマー病、パーキンソン病、多発性硬化症、動脈硬化、皮膚の硬化などは加齢に伴って生じる原因不明の疾患です。これらに共通しているのはその組織を構成する蛋白質(アミノ酸の鎖状構造)の中に正常では存在しないD-アミノ酸が存在しており、そのために蛋白質が異常凝集化し、不溶化蛋白質が蓄積して、機能不全に陥っていることです。
私たちは他に先駆けて、加齢性白内障患者の水晶体のクリスタリンのアスパラギン酸 (Asp) 残基がD-体化している特定部位を見出し、蛋白質中でのD-アミノ酸生成機構を明らかにしてきました。そして現在、蛋白質中のアミノ酸のD-体化による機能変化、D-体化促進因子の研究、微量D-アミノ酸分析法の開発、代謝産物としてのD-アミノ酸含有ペプチドの探索を行っています。これらの化学的研究によりD-アミノ酸は体内のどの蛋白質にも普遍的に生じるということが分かってきました。白内障のみならず、今日の社会問題となっている神経疾患や他の加齢性疾患にもD-アミノ酸を分子指標とする研究を展開しながら、加齢性疾患早期検出システムの開発、予防薬の開発を目指しています。学問的にも、生体というL-アミノ酸ホモキラルワールドにおいてL-アミノ酸の鏡像異性体であるD-体も同時に考慮するという、新しい概念を生命科学に導入した他に類を見ない特徴を有しています。
研究概略: D-アミノ酸とは?
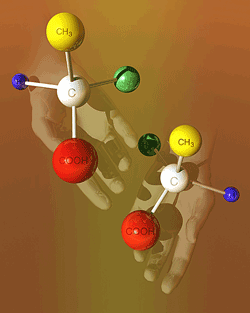
蛋白質の構成ユニットであるアミノ酸は炭素(C)にアミノ基(-NH2)、カルボキシル基(-COOH)、水素(H)、各アミノ酸に応じた側鎖(ここに20種類のアミノ酸の性質の違いによって酸性、塩基性、親水性、疎水性などが生じる)が結合しています。アミノ酸のうち、RがHであるグリシンを除いた19種類のアミノ酸はすべてL-体とD-体が存在します。L-アミノ酸とD-アミノ酸は左手と右手のように鏡に映した「形」の異なる関係にあり、その物理的・化学的性質は全く同じです(右図)。しかしながら、地球上の全生物の生体内で合成されるアミノ酸は遊離型、結合型を問わず、すべて、左手構造であるL-体のアミノ酸から構成されています。体内で合成される蛋白質はL-アミノ酸のみがペプチド結合で数百個連結してできた高分子化合物(ポリマー)であり、蛋白質は、L-アミノ酸のみのホモキラリティー(片手構造)が維持されており、正しいフォールディング(折りたたみ構造)が形成されその機能を発揮しています。
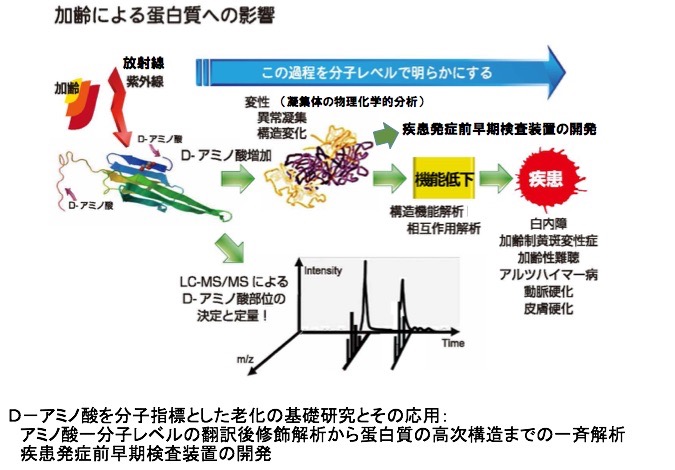
食品の加熱や加工過程でL-アミノ酸からD-アミノ酸へと変化(ラセミ化)することはよく知られているところですが、生体内のような温和な条件下では蛋白質構成アミノ酸のホモキラリティーは破られることはないと信じられていました。しかし、近年、眼の水晶体、網膜、結膜、角膜や脳、歯、動脈壁、靭帯、皮膚など種々の組織中蛋白質内に構成アミノ酸の一種であるAspが加齢に伴ってL体からD体へとラセミ化し、白内障、加齢性黄斑変性症、アルツハイマー病、皮膚の硬化、動脈硬化等の様々な加齢性疾患の発症に関与することが明らかになってきました。D-Aspは長期間にわたる加齢の過程で、非酵素的に生体内ラセミ化反応によって生じます。上記の組織では共通して蛋白質が異常凝集化して疾患を引き起こしていますが、その引き金となるのはD-Aspの増加である可能性が高いと考えられます。なぜなら、ペプチド結合中にD-アミノ酸が生じると周辺の立体構造が変化し、他の蛋白質との相互作用も異なるためです。蛋白質の最も基本的性質であるアミノ酸のホモキラリティーが、実は一個体の老化の過程で喪失しているという驚くべき事実が近年、注目を浴びています。D-アミノ酸生成を阻止できれば疾患の予防が可能となるでしょうし、老化現象の遅延も可能になるかもしれません。多くの加齢性疾患の原因蛋白質中のD-アミノ酸を特定し、その形成と疾患との繋がりを明らかにし、その予防策を確立することが我々の研究です( 下図)。
研究標的: 白内障とは?
白内障は水晶体が混濁し,視力低下をきたす疾患で、我が国では80歳以上の人の罹患率がほぼ90%にも上る代表的な加齢性疾患です。 放射線被曝,紫外線被曝,糖尿病,アトピー性皮膚炎等の外的・内的要因によっても促進されるといわれていますが,主たる要因は加齢によるものです。 その発症機構は,水晶体を構成するクリスタリン蛋白質が会合し,凝集することで水晶体の透明性が失われるためと考えられています。水晶体の透明性に寄与するのはクリスタリンファミリーの秩序だった構造です。水晶体中の蛋白質は主にα, β-, γ-クリスタリンと呼ばれる構造蛋白質から構成されています。α-クリスタリンはαA-, αB-の2サブユニットから, β-,γ-クリスタリンはそれぞれ7サブユニットから成り、これらの蛋白質が互いに相互作用して秩序だった構造を保持しています。この秩序構造が干渉効果をもたらし,透明性を維持しています。しかし,これら蛋白質の構造に変化が生じ,秩序構造が乱れ,凝集が進み,不溶化した会合体が生じると,光の散乱によって混濁が生じ白内障となります。
秩序正しい構造を保持していたクリスタリンがどのようなきっかけで異常凝集するのか、これまで不明でしたが、私たちはヒトの老人性白内障の水晶体成分からαA-クリスタリンの58番目と151番目のAsp, αB-クリスタリン中の36番目と62番目,βB2-クリスタリンの4番目のAspが5員環イミド体を介して部位特異的にD−体に反転し, 同時にこれらのD-Aspが有する隣接アミノ酸残基との結合がα結合からβ結合へと異性化(β-Asp化)し蛋白質の基本構造であるペプチド構造に変化を生じさせていることを初めて見出しました。この結果から,クリスタリン中のAsp残基の反転異性化がクリスタリンの構造変化と異常凝集を招き白内障に至るのではないかと考えています。また近年では、これらのD-Aspへの変化がクリスタリン特有のシャペロン機能にも影響することが明らかになりつつあります(下図・左)。
実は、上記反応は非酵素的に時間経過とともに生じる異性化反応なので、D−体化する速度を予測することも可能です。蛋白質中のD−アミノ酸は微量なので、それをいかに迅速に、正確に定量するかという分析技術の開発も本研究の進展に欠かせない要素です。 このような基礎研究をもとにした、白内障早期発見を目的とした非侵襲検査装置を現在は開発しています。水晶体蛋白質の凝集化、構成蛋白質のD−体化によるペプチド構造異常、アミノ酸1残基ごとの変化(酸化、脱アミド化、異性化など)を定量的にとらえる疾患早期発見装置の開発は白内障のみならず、他の加齢性疾患にも応用できると考えています(下図・右)。

研究テーマ: 当研究室では現在、D-アミノ酸と加齢現象の総合的理解の深化のために、以下の研究を実施しています。
1. 加齢性疾患に生じる蛋白質変性をとらえる非侵襲的検査装置の開発
2. D -アミノ酸を加齢指標(バイオマーカー)として利用する抗加齢研究
3. 水晶体以外の加齢組織(神経変性疾患、網膜疾患など)のD-アミノ酸含有蛋白質の同定
4. 質量分析(LC-MS/MS-MRM)による蛋白質中の新規D-アミノ酸分析法の開発、改良とその応用
5. D-アミノ酸と他アミノ酸修飾についての関連についての研究
6. 放射線、紫外線などストレスに晒された蛋白質中のアミノ酸修飾が引き起こす蛋白質異常凝集に関する研究
7. 血中におけるD-アミノ酸含有ペプチド(DAP) の探索と疾患バイオマーカーの確立
その他の研究紹介: 以下は、我々の研究が紹介されているリンクになります。
2. Youtube サイエンスチャンネル 原子炉が解く?右ききアミノ酸の反乱 (音が出ます)