 大学院生募集! 大学院生募集!
タンパク質について研究してみませんか?
例えば、
☆タミフルはどのようにインフルエンザウイルスに結合し、効果を発揮する
のでしょうか?
☆蛍はどのように光を発しているのでしょう??
☆好熱菌と呼ばれる菌類は、どのようにして100℃近い環境に生息できているの
でしょうか???
そんなことも明らかになる学問です。
以下にタンパク質の構造解析について簡単に説明します。
興味を持たれた方は気軽にご連絡ください。
☆タンパク質について
タンパク質とは、アミノ酸がペプチド結合によって、ひも状に連なったものが、それぞれのタンパク質に特有の立体構造に折れたたまれたものです。 この立体構造をとることによって、相互作用する相手分子(他のタンパク質や低分子など)を数Åのオーダーで判別することが可能となります。
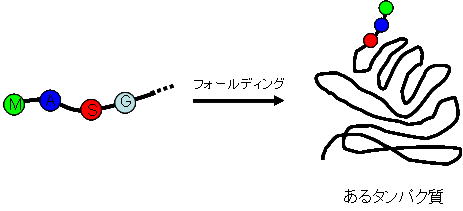
☆フォールディングについて
タンパク質が、特定の立体構造に折りたたまれることをタンパク質のフォールディングといいます。 数百~数千連なったアミノ酸が、折りたたまれる場合の数は無数に存在するため、現在でもシミュレーションなどを用いて、タンパク質の立体構造を明らかにすることはできていません。 しかし、生体内では、このフォールディングが数秒で正確に行われてしまうのです。 このフォールディングの機構は未だ、完全には解明されておらず、Levinthalのパラドクスといわれています。
☆タンパク質の構造解析
では、タンパク質の構造解析はどのように行われるのでしょうか。
現在、タンパク質の構造解析の手法として、NMRと結晶構造解析の2つが主流となっています。森本研究室では後者の結晶構造解析を行っています。 結晶構造解析はその名の通り、タンパク質の結晶を作製し、結晶に放射線をあて、構造解析を行います。 タンパク質の結晶方法には決まった方法が確立されておらず、結晶作製には苦労しますが、その分、結晶が出たときの感動は大きいです。 下に結晶の写真を載せておきます。 きれいでしょ☆
 
☆構造解析の必要性
タンパク質の構造解析を行う目的は、タンパク質の機能を原子レベルで明らかにすることにあります。
例えば、血液中の酸素を運搬することで知られるヘモグロビンは、ヒトの場合、肺から送られた酸素と結合し、血液中の酸素濃度が低いポイントにくると、その構造を変化させ、酸素を離すという仕事をしています。 この酸素をつかみ、必要な所で離すという機能はどのようにして行われているか、ご存知ですか?
また、このような立体構造を原子レベルで明らかにする事は、薬剤の設計や、工業的利用への応用につながります。
☆この分野の面白さ
上であげた、フォールディングの機構や結晶化の方法などの様に、この分野にはまだまだ明らかになっていないこと、改良すべきことが多く存在しています。 また、未だ多くのタンパク質の立体構造が明らかになっておらず、実際に生体内で巧みに機能しているタンパク質の立体構造を、世界で最初に見ることができる事も、この分野の面白い点でしょう。
最後に、以下にこの分野ですることのできる実験の例をあげておきます。 どれも物理学専攻としては、めずらしく、興味深いものだと思います。
・ 大腸菌の培養 →大腸菌を培養し、目的のタンパク質を作らせる。
・ 遺伝子組み換え →タンパク質の長さなどを変える必要があるときは、遺伝子組み換えを行う。
・ タンパク質の結晶化 →この分野の基本。様々な条件を変えて、質のいい結晶を作ることが重要!
・ 放射光施設の利用 →結晶が得られたら、Spring8(兵庫県)や、高エネルギー加速器研究機構(茨
城県)に出張し、放射光を用いて回折実験を行う。
|
|

