The first Japanese SEC-SANS is go!
京大複合研杉山グループと東大物性研眞弓グループおよび株式会社ユニソクの中川は共同で、溶液中の凝集体を除去して目的分子(主に生体高分子)の高精度な散乱データを取得可能とするSEC-SANSシステムを東大物性研が運用するSANS装置(SANS-U)への導入に成功しました。
溶液小角散乱、特に生体高分子溶液の小角散乱において一番の大敵は、溶液中に存在する凝集体です。精製直後はほとんど存在しなくても、精製から測定までの輸送による振動、凍結・融解等の擾乱などにより試料によっては凝集体の蓄積は避けられません。この問題の解決として、ビームラインに精製装置(Size-exclusion chromatography:SEC)を設置し、精製直後=凝集体を含まない試料溶液を直ちに測定する手法が放射光の小角散乱装置において開発されました(SEC-SAXS法)。このSEC-SAXS法はこれまでの多くの散乱データを塗り替え、現在の放射光施設の生体高分子を対象とするSAXSにおける基本的な装置となっています。同時に、このSEC-SAXSの中性子版=SEC-SANSの開発はSANSを用いる生命科学関係者の悲願となりました。そして、SEC-SANSは2018年にILLのD22で初めて実用化され、ORNLのBioSANSでの設置と続きました。これらSEC-SAS(SEC-SAXS, SEC-SANSの統合名称)では、SECからの溶液を流れるままに測定するため、必然的に試料を測定する時間は短く(数分程度)なります。そのため、短時間測定が可能な高強度ビームが利用できることSAS装置(例えば、放射光SAXS)が必須とされていました。
我々は、この問題に挑戦し、流路・流速・セル形状の工夫により2019年に実験室SAXS用のSEC-SAXSの開発し、この経験を生かして、今回SANS-Uに最適化したSEC-SANS装置の開発に成功しました。このSEC-SANSにより凝集体等の不純物を含まない高精度の散乱データを得ることが可能となり、計算機シミュレーションを用いた構造変調やダイナミクスの解明の一層の進展が期待できます。また、中性小角散乱の特長は重水素化を利用した複合タンパク質の特定部位の選択測定(inverse-Contrast-Matching SANS: iCM-SANS)ですが、図(今回測定データ)に示すように、SANS-Uに設置したSEC-SANSシステムにより(A+B)複合タンパク質中のB領域の選択的測定も可能なっております。
同装置は、2024年度後半より利用可能とする予定です。
ご興味のある方は遠慮なく杉山
sugiyama.masaaki.5n※kyoto-u.ac.jp(※を@に変えてください。)までお問い合わせください。
図(a) : SEC-SANSシステムの概要。下段はSECチャート。目的成分の溶出時間(網掛した時間)でバルブを切り替えSANSセルに流入させます。 図(b) : 逆転コントラストマッチング(iCM)法を用いたSEC-iCM-SANSの測定例。タンパク質Aのみを部分重水素化により散乱的に不可視化することで、複合体中のB領域の部分構造解析が可能です。

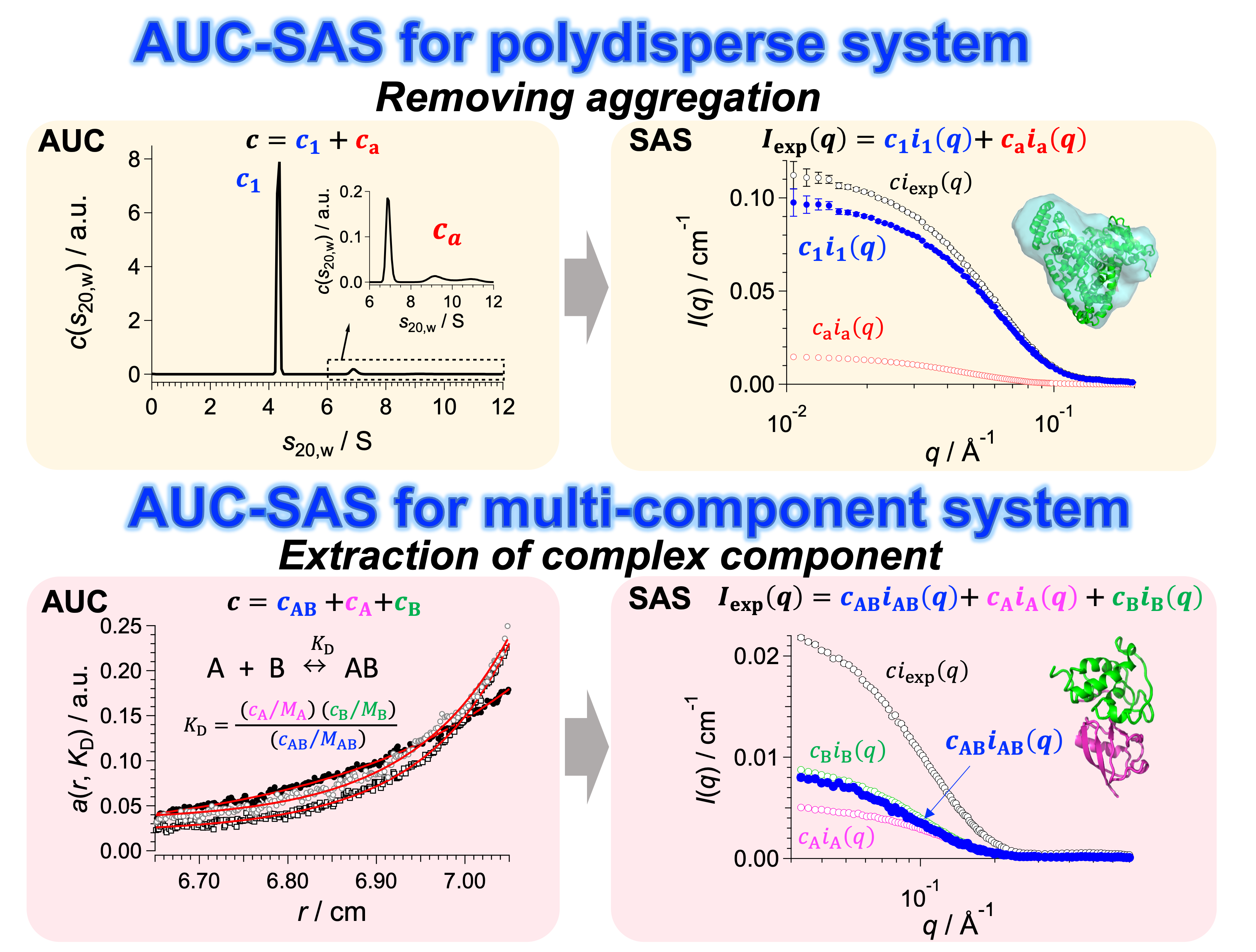
小角散乱と超遠心分析の複合的アプローチによる多分散・多成分溶液における構造解析:AUC-SAS
X線や中性子を用いた小角散乱(SAS)では溶液中の全分子の集団平均の散乱プロファイルが得られるため、単分散となるように精製した試料を用いる。しかしながら精製直後にも関わらず目的分子同士の凝集体が残存する「多分散系」や、解離会合平衡により複数種類の分子や複合体が共存する「多成分系」では、目的分子(あるいは目的複合体)の散乱プロファイルを得ることが困難である。そこで、超遠心分析(AUC)で得られる溶液中の分子の重量分率を用いてSASプロファイルを成分分離するアプローチ「AUC-SAS」を開発した。AUC-SAS法は、サイズ排除クロマトグラフィー(SEC)によって単離が難しい試料や、小角散乱装置にSECが併設されていない場合に威力を発揮する。
多分散(凝集を含む系)に対するAUC-SASソフトウェアは
(http://www.rri.kyoto-u.ac.jp/NSBNG/activity.html)でダウンロード可能。
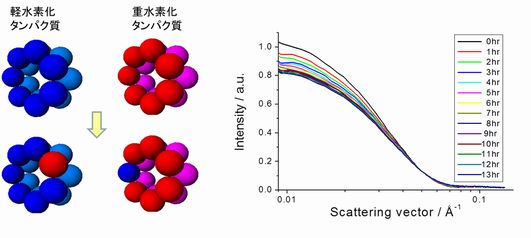
複合タンパク質間のサブユニット交換現象の解明
複合タンパク質間で構成要素のサブユニットが交換しているという現象を発見した。実験は、重水素と軽水素を見分けると言う中性子の特徴を生かし、特別に作成した重水素化タンパク質と(普通の)軽水素化タンパク質を混合し、中性子小角散乱の散乱強度の経時変化を測定した。この時、両者間でサブユニットが交換現象が発生すれば、散乱強度は減少していく。下図は、実際のデータで確かに散乱強度が減少していることが分かる。
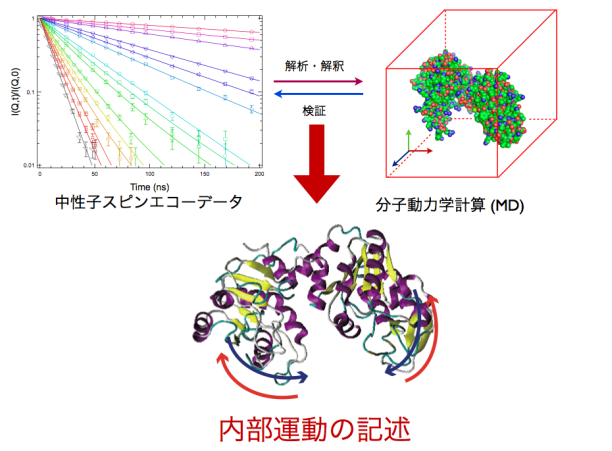
マルチドメインタンパク質の内部運動の直接観察
マルチドメインタンパク質の内部運動はタンパク質自身の機能に密接に関与するこ とがこれまで主に計算的手法により予測されてきたが、実験的に内部運動を観る手法 は非常に限られており、その非常に限られた手法においてもラベリング等の系に対し て摂動となり得る操作が必要とされる。 最近、我々は中性子スピンエコー法 (NSE) を用いるとラベリング操作無しで溶液 中のタンパク質の内部運動を観測出来ることを明らかにした。しかしながら、今後よ り構造的に複雑なタンパク質の内部運動の記述にはより高度な解析手法の確立が必要 不可欠である。 そこで、現在我々はNSE法と分子動力学計算 (MD) をカップルさせた新規解析手法 の確立を目指している。
マルチドメインタンパク質の溶液構造
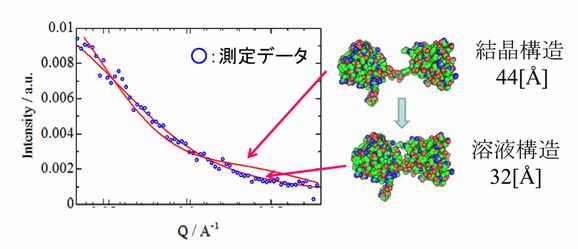
タンパク質は特異的な立体構造を持ち機能を発現していると考えられている。この立体構造は単結晶X線構造解析法により詳細に解明されるが、実際のタンパク質は結晶状態ではなく細胞中で溶解して存在していることが多く、その構造は結晶構造と異なっていると考えられる。 我々は溶液中のタンパク質の構造を中性子小角散乱法を用いて解明することを目指している。水晶体を構成するタンパク質の1つβB2クリスタリンは、図にあるように2つのドメインを持っている。結晶構造解析の結果では、44Å離れているが、この構造モデルでは溶液中のβB2クリスタリンの中性子小角散乱曲線は再現できない。そこで、RMC法を用いた解析を行った結果、2つのドメインは32Åまで接近しており、ほとんど接している事が判明した。